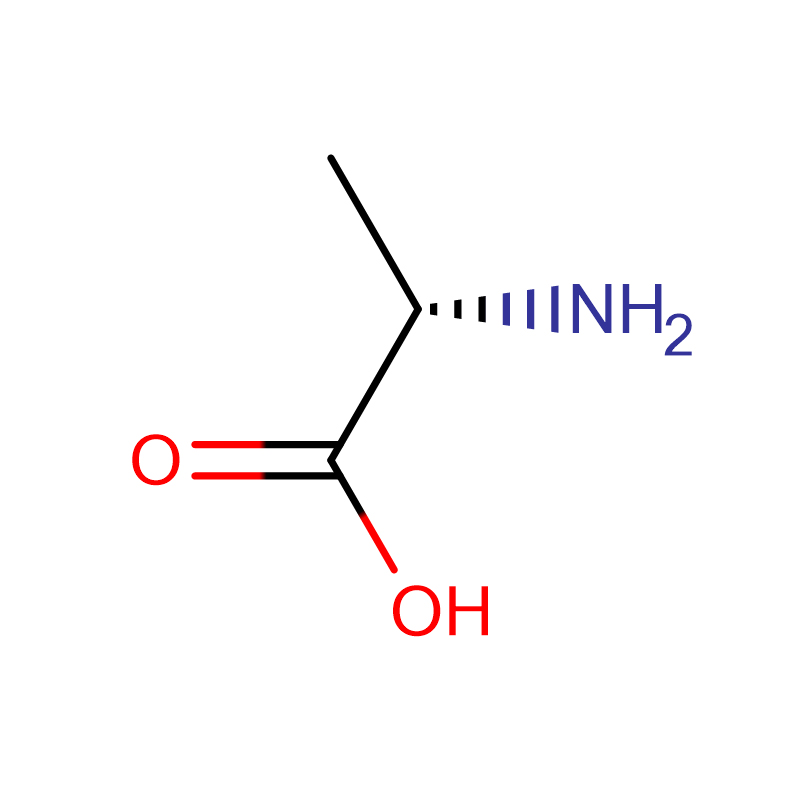
L-Alanine CAS:56-41-7 99% Pluhur kristalor i bardhë
| Numri i Katalogut | XD90326 |
| Emri i produktit | D-Alanine |
| CAS | 338-69-2 |
| Formula molekulare | C3H7NO2 |
| Peshë molekulare | 89.09 |
| Detajet e ruajtjes | Ambient |
| Kodi tarifor i harmonizuar | 29224985 |
Specifikim produkti
| Pamja e jashtme | Pluhur kristalor i bardhë |
| Analiza | 98,5 - 101,5% |
| Rrotullim specifik | +13,7 deri +15,1 |
| Metalet e renda | <0,0015% |
| pH | 5.5 - 7 |
| SO4 | <0.03% |
| Humbje gjatë tharjes | <0.2% |
| Hekuri | <0.003% |
| Mbetjet në ndezje | <0,15% |
| Madhësia e grimcave | 200 vjet |
| Cl | <0,05% |
| Niveli i ndotësve organikë të qëndrueshëm | Nuk ka ndotës |
γ-glutamiltranspeptidazat (γ-GTs) çajnë lidhjen γ-glutamyl amide të glutationit dhe transferojnë grupin γ-glutamil të çliruar në ujë (hidrolizë) ose aminoacide pranuese (transpeptidim).Këto enzima të kudondodhura luajnë një rol kyç në biosintezën dhe degradimin e glutationit, dhe në detoksifikimin ksenobiotik.Këtu raportojmë strukturën kristalore me rezolucion 3Å të Bacillus licheniformis γ-GT (BlGT) dhe atë të kompleksit të tij me l-Glu.Strukturat me rreze X konfirmojnë se BlGT i përket superfamiljes së hidrolazës nukleofile N-terminale dhe zbulojnë se proteina posedon një çarje të hapur të zonës aktive të ngjashme me atë të raportuar për enzimën homologe nga Bacillus subtilis, por e ndryshme nga ato të vëzhguara për γ-GT njerëzore dhe për γ-GT nga mikroorganizma të tjerë.Të dhënat sugjerojnë se lidhja e l-Glu shkakton një rirenditje të bishtit C-terminal të nën-njësisë së madhe BlGT dhe lejon identifikimin e një grupi mbetjesh acidi që janë potencialisht të përfshirë në njohjen e një joni metalik.Roli i këtyre mbetjeve në stabilitetin konformativ të BlGT është studiuar duke karakterizuar autopërpunimin, aktivitetin enzimatik, denatyrimin kimik dhe termik të katër mutantëve të rinj Ala të vetëm.Rezultatet tregojnë se zëvendësimi i Asp568 me një Ala ndikon si në autopërpunimin ashtu edhe në stabilitetin strukturor të proteinës.